Höhleninhalte
 Der Boden ist mit kantig-eckigen Steinen und Erde bis zum Ende der Höhle überdeckt, am Schluss des Ganges ist der Boden aus Lehm. Die Wände sind zum Teil versintert, vor allem im Schacht.
Der Boden ist mit kantig-eckigen Steinen und Erde bis zum Ende der Höhle überdeckt, am Schluss des Ganges ist der Boden aus Lehm. Die Wände sind zum Teil versintert, vor allem im Schacht.

| Sedimente in Höhlen Ablagerungen, Ausscheidungen und Mineralien in unterirdischen Hohl-räumen werden unter dem Begriff Höhlensedimente zusammen-gefasst. |
 |
|
Es werden drei Hauptgruppen von Höhlensedimenten unterschieden: |
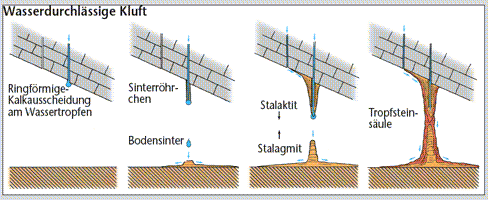
Tropfsteine entstehen auf folgende Weise: Im belebten Boden bildet sich durch Abbauprozesse und Wurzelatmung Kohlendioxid, das im Regenwasser als Kohlensäure in Felsritzen versickert und Kalk auflöst. Wenn dieses Wasser in einen Höhlenraum eintropft, kann Kohlendioxid als Gas aus dem Wasser entweichen, worauf wieder Kalk ausfällt und Tropfsteine bildet. Verdunstung ist dabei von untergeordneter Bedeutung. |
|
Detritische Sedimente
(detritisch bedeutet zerbrochen). Sie sind Ablagerungen aus einem bereits bestehenden Gestein oder Mineral, z.B.Versturzblöcke, gerundete Bachgerölle, Sand und Lehm.
Chemische Sedimente
Als chemisch ausgefällte Sedimente gelten alle Sorten von Tropfsteinen und Kalzitausscheidungen unter dem Begriff Sinter. Die Farben wechseln von weiss über gelb, rot und braun bis schwarz, je nach Humusbestandteilchen und Mineralien.
Weitere chemische Sedimente sind Mineralausblühungen an Wänden und auf Ablagerungen
Biogene Sedimente
Darunter verstehen wir Knochen und Schalen von Tieren, Guano (Fledermauskot), aber auch Steinzeitwerkzeuge.
Eis in Höhlen
Höhleneis bildet sich meist in Höhlen, in denen sich im Winter kalte Luft gestaut hat.



Chemie der Höhlen
Die Höhlenentstehung beruht auf eindringendem kohlensäurehaltigem Wasser, gebildet aus dem CO2 der Bodenluft,welches das wenig lösliche Kalziumkarbonat (15 mg/L) des Kalkgesteins in gut lösliches Kalziumbikarbonat (1.5 g/l) umwandelt und somit chemisch auflöst.
Auch der umgekehrte Vorgang findet statt, man nennt dies Sinterbildung.
Am bekanntesten sind die Tropfsteine, z.B. die herunterhängenden Stalaktiten und die nach oben wachsenden Stalagmiten. Diese entstehen, wenn mit Kalziumbikarbonat gesättigtes Wasser in die Höhle eindringt.
In der kohlendioxidärmeren Höhlenluft findet ein Ausgasen statt, worauf das Wasser nicht mehr das gesamte gelöste Kalziumkarbonat in Lösung halten kann. Der überschüssige Anteil kristallisiert aus und lagert sich in Form von reinem Kalziumkarbonat ab. Verdunstung ist dabei von untergeordneter Bedeutung.